SUCCESS-Studie |
Das deutsche Kurzprotokoll als Download (PDF 300 KB, 07.2006) |
| |
|
|
|
|
Multizentrische prospektiv randomisierte Phase III Studie zum Vergleich von FEC-Doc-Chemotherapie versus FEC-DocG-Chemotherapie, sowie 2 versus 5 Jahre Zoledronattherapie in der adjuvanten Therapie von Patientinnen mit Brustkrebs |
| |
|
|
|
|
in Kooperation mit : |
 |
 |
|
| |
|
|
|
|
empfohlen von: |
 |
|
|
| |
|
|
|
|
Kurzprotokoll (Version 1.2) |
Studienleitung:
Prof. Dr. med. W. Janni (LKP)
Klinikum der Heinrich-Heine-Universität Düsseldorf
Klinik und Poliklinik für Frauenheilkunde
Moorenstraße 5
D- 40225 Düsseldorf
Tel: 0211 – 81 17 501
Fax: 0211 – 81 18 407
Prof. Dr. H. Sommer (Sponsor)
I. Universitätsfrauenklinik
Klinikum Innenstadt der LMU
Studienzentrum Onkologie
Maistraße 11
D – 80337 München
Tel: 089 – 5160 – 4170 Studiensekretariat
089 – 5160 – 4111 Zentrale
Fax: 089 – 5160 – 4715
Email: success@med.uni-muenchen.de
Web: www.success-studie.de
|
Co-Studien-Direktoren:
Prof. Dr. M. W. Beckmann
Universitätsfrauenklinik Erlangen
Prof. Dr. W. Lichtenegger
Universitätsfrauenklinik Charité Berlin
Chair Advisory Board:
Prof. Dr. A. Schneider
Universitätsklinik Benjamin-Franklin Berlin
|
Randomisation und CRO:
Alcedis GmbH,
Winchesterstr. 2
D – 35394 Gießen
Tel: 0641 – 94436 – 0
Fax: 0641 – 94436 – 70
Email: success-cro@alcedis.de
Statistik:
Estimate GmbH,
Konrad-Adenauer-Allee 1
D – 86150 Augsburg
Tel: 0821 – 34662 – 0
Fax: 0821 – 34662 – 22
Email: info@estimate.de
|
| |
|
|
|
|
Zielsetzung der Studie |
| |
|
|
|
|
Hauptzielkriterium:
Primäres Studienziel ist der Vergleich der rezidivfreien Überlebenszeit nach Randomisierung von Patientinnen, die adjuvant 3 Zyklen 5-Fluorouracil-Epirubicin-Cyclophosphamid (FEC)-Chemotherapie, gefolgt von 3 Zyklen Docetaxel (D)-Chemotherapie versus 3 Zyklen FEC-Chemotherapie, gefolgt von 3 Zyklen Gemcitabin-Docetaxel (DG)-Chemotherapie erhalten, sowie der Vergleich der rezidivfreien Überlebenszeit nach Randomisierung von Patientinnen, die 2 Jahre versus 5 Jahre mit Zoledronat behandelt werden.
Sekundäre Zielkriterien:
- Gesamtüberleben nach Randomisation
- Fernmetastasenfreies Überleben
- Toxizität
- Lebensqualität
- Prädiktiver und prognostischer Wert von Minimal Residual Disease im peripheren Blut
- Skelettbezogene Ereignisse
- Häufigkeit von Zweitkarzinomen
|
| |
|
|
|
|
Einschlusskriterien |
| |
|
|
|
|
- Primäres epitheliales invasives Mammakarzinom pT 1-4 , pM 0
- Histologischer Nachweis axillärer Lymphknotenmetastasen pN 1-3 oder nodal negative high-risk Patientinnen N o/x , definiert als pT > 2 oder histopathologisches Grading 3 oder Alter ≤ 35 oder negativer Hormonrezeptorstatus
- R 0 -Resektion des Primärtumors (Resektionsränder frei von invasiven Karzinomanteilen, in-situ-Anteile jedoch erlaubt), maximal 6 Wochen vor Randomisation
- Frauen älter als 18 Jahre
- Allgemeinzustand ≤ 2 auf der ECOG-Skala
- Adäquate Knochenmarksreserve: Leukozyten > 3.0 x 10 9 /l und Thrombozyten > 100 x 10 9 /l
- Bilirubin innerhalb Normalwert, GOT, GPT, Alkalische Phosphatase innerhalb 1,5-fachem Normalwert des jeweiligen Referenzlabors
- Gewährleistung regelmäßiger Nachsorge während der Studiendauer
- Verständnis des Studienkonzepts und schriftliche Einverständniserklärung
|
| |
|
|
|
|
Ausschlusskriterien |
| |
|
|
|
|
- Inflammatorisches Mammakarzinom (bilaterales Mamma-Ca ist kein Ausschlusskriterium)
- Vorangegangene oder gleichzeitige Therapie mit anderen zytotoxischen oder antineoplastischen Medikamenten, die nicht innerhalb des Protokolls vorgesehen sind
- Vorgeschichte von Erkrankungen mit Einfluss auf den Knochenstoffwechsel wie z.B. M. Paget und primärer Hyperparathyreoidismus
- Vorausgegangene Behandlung mit Bisphosphonaten innerhalb der letzten 6 Monate
- Eingeschränkte Nierenfunktion: Creatinin-Clearance ≤ 30 ml/min nach der Cockcroft-Gault-Formel:
|
CrCl= |
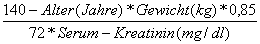 |
|
|
|
|
|
|
|
- Zweitkarzinom (außer In-situ-Karzinom der Cervix uteri oder adäquat behandeltes Basaliom)
- Manifeste kardiale Vorschädigung (Kardiomyopathie mit verminderter Ventrikelfunktion (NYHA > II), therapiebedürftige Arrhythmien mit Einfluss auf die LVEF, Z. n. Myokardinfarkt oder Angina pectoris innerhalb der letzten 6 Monate, medikamentös nicht eingestellter arterieller Hypertonus)
- Jede bekannte Überempfindlichkeit gegenüber Docetaxel, Epirubicin, 5-Fluorouracil, Cyclophosphamid, Gemcitabin, Zoledronat oder sonstigen Studienmedikamenten
- Behandlung mit einem zu untersuchenden Medikament in den letzten 3 Wochen vor Studieneintritt
- Bestehende dentale Beschwerden, Kiefer- und Zahnentzündungen oder akute oder vorbestehende Kiefernekrosen, von exponierten Knochen in der Mundhöhle, oder von langsam heilenden Wunden nach Zahnbehandlungen
- Kürzlich durchgeführte (6 Wochen) oder geplante Zahn- oder Kieferoperationen (Extraktionen, Implantate)
- Patientinnen in Schwangerschaft oder Stillzeit (bei prämenopausalen Frauen muss eine sichere Kontrazeption gewährleistet werden: Intrauterinpessare, operative Sterilisation oder, nur bei hormonrezeptornegativen Mammakarzinompatientinnen, orale, subkutane oder transvaginale, nicht östrogenhaltige Kontrazeptiva)
|
| |
|
|
|
|
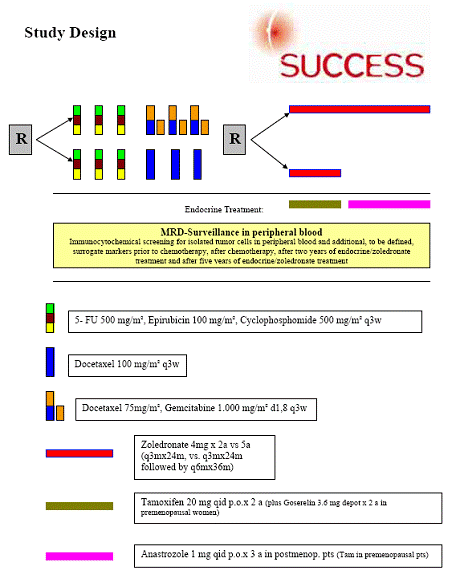
Studiendesign |
| |
|
|
|
|
 |
| |
|
|
|
|
Randomisation A:
AA: 5-Fluorouracil 500 mg/m2 und Epirubicin 100 mg/m2 und Cyclophosphamid 500 mg/m2 i.v. KOF q3w x 3 (alle nur an Tag 1 verabreicht)
gefolgt von Docetaxel 75 mg/m2 (nur an Tag 1) und Gemcitabine 1000 mg/m2 i.v. KOF
q3w x 3 (an Tag 1 und Tag 8 verabreicht)
AB: 5-Fluorouracil 500 mg/m2 und Epirubicin 100 mg/m2 und Cyclophosphamid 500 mg/m2 i.v. KOF q3w x 3
gefolgt von Docetaxel 100 mg/m2 i.v. KOF q3w x 3 (alle nur an Tag 1 verabreicht)
Randomisation B:
BA : Zoledronat 4 mg i.v. q3m x 24m
gefolgt von Zoledronat 4 mg i.v. q6m x 36m
BB: Zoledronat 4 mg i.v. q3m x 24m
|
| |
|
|
|
|
Bestrahlung:
Patientinnen nach brusterhaltender Therapie erhalten obligat eine Strahlentherapie. Patientinnen nach Mastektomie erhalten eine adjuvante Radiatio, wenn mindestens einer der im Studienprotokoll genannten zusätzlichen Risikofaktoren vorliegt. |
| |
|
|
|
|
Therapie mit Trastuzumab (Herceptin®):
Bei Patientinnen mit einem eindeutig HER2-neu überexprimierenden Tumor (IHC+++ oder FISH+) wird die Therapie mit Trastuzumab nach Abschluss der Chemotherapie über ein Jahr empfohlen. Diese sollte nach Beendigung der Strahlentherapie beginnen.
Dosierung: 8 mg/kg KG loading dose, gefolgt von 6 mg/kg KG, q3w, für 1 Jahr |
| |
|
|
|
|
Endokrine Anschlussbehandlung bei positivem Hormonrezeptorstatus (Östrogen- u/o Progesteronrezeptor ab 10 %) (nach Abschluss der Chemotherapie) : |
| |
|
|
|
|
| Ausgangssituation |
Behandlung |
|
|
|
|
|
|
|
| Prämenopausale Patientinnen |
p.o. für 5 Jahre |
|
|
|
|
|
|
|
| Falls Patientin < 40 Jahre oder Menstruation innerhalb von 6 Monaten nach Ende der Chemotherapie oder LH < 20 mIE/ml, FSH < 20 mIE/ml und E 2 > 20 pg/ml (unabhängig vom Lymphknotenstatus) |
Zusätzlich Goserelin (Zoladex ®) 3,6 mg/Monat |
s.c. q4w für 2 Jahre |
|
|
|
|
|
| Postmenopausale Patientinnen |
Tamoxifen 20 mg p.o. für 2 Jahre
|
nachfolgend Anastrozol (Arimidex ®) 1mg p.o. für weitere 3 Jahre
|
| |
|
|
|
|
| Bei Kontraindikationen oder Unverträglichkeit gegen Tamoxifen |
Anastrozol (Arimidex ®) 1mg p.o. für 5 Jahre |
|
|
| |
|
|
|
|
Behandlungsplan |
| |
|
|
|
|
|
|
|
|
|
| Allgemeine Empfehlungen zur Therapiedurchführung |
| |
|
|
|
|
|
|
|
|
|
- In beiden Therapiearmen sollte eine adäquate Behandlung mit Antiemetika (z.B. 5-HT-3 Antagonisten 15 min vor Infusion) durchgeführt werden. Weitere Gaben sollten nach Bedarf auch an den folgenden Tagen durchgeführt werden.
- Bei der Berechnung der Körperoberfläche sollen die aktuelle Körpergröße und das Körpergewicht für die Berechnung der Körperoberfläche (KOF) herangezogen werden. Bei übergewichtigen Patienten sollte eine maximale KOF von 2 m² zugrunde gelegt werden.
- Die Behandlung mit G-CSF (Granocyte®) sollte sekundär-prophylaktisch in einer Dosierung von einer Ampulle G34 / Tag gegeben werden bei:
- jeder febrilen Neutropenie
- Neutropenie < 0,5 x 10 9/l über mehr als 5 Tage
- Neutropenie < 0,1 x 10 9/l
- Intervallverlängerung wegen Leukopenie
Tritt eines dieser Kriterien auf, so erfolgt in allen nachfolgenden Zyklen die Gabe von
G-CSF. Die sekundär-prophylaktische Gabe von 1 Ampulle G34 / Tag erfolgt von Tag 5 bis Tag 10, oder bis die Leukozytenzahl nach dem Nadir 5.000/µl überschritten hat |
| |
|
|
|
|
|
|
|
|
|
| |
|
- Beim Auftreten einer Neutropenie Grad 3/4 kann in beiden Therapiearmen fakultativ eine prophylaktische orale Antibiose (z.B. Ciprofloxacin (Ciprobay®) 500 mg p.o. 2 x/tgl., Levofloxacin (Tavanic®) 500 mg p.o. 1 x/tgl.) gegeben werden. Diese wird jedoch empfohlen, falls die Neutrophilen Granulozyten auf < 0,5 x 10 9 /l abfallen (unabhängig von G-CSF-Gabe).
- Bei jedem Fieber ist unbedingt eine Abklärung (s.u.) erforderlich. Jede febrile Neutropenie muss stationär mit i.v.-Antibiose behandelt werden!
|
|
|
| |
|
|
|
|
|
|
|
|
|
| Während der Zoledronattherapie bekommen die Patientinnen zusätzlich 500 mg Calcium p.o. qd und 400 I.E. Vitamin D p.o. qd verabreicht. Die Serumspiegel von Calcium, Phosphat und Magnesium sollten nach Einleitung der Zoledronattherapie sorgfältig überwacht werden. |
| |
|
|
|
|
|
|
|
|
|
Komplikationen während der Neutropenie |
| |
|
|
|
|
|
|
|
|
|
Febrile Neutropenien sollten nach dem NCI-Score beurteilt werden. Die Körpertemperatur sollte möglichst als Körperkerntemperatur bestimmt werden.
Kommt es bei einer Patientin zu Fieber (Kerntemperatur > 38.0 ° C) im Rahmen einer Neutropenie Grad 3 oder 4, so wird das folgende Vorgehen vorgeschlagen:
- Stationäre Einweisung ( keineambulante Antibiotikatherapie! ), ggf. Umkehrisolation.
- Differential-Blutbildkontrolle, stündl. Temperatur-, Puls- und RR-Kontrolle, ggf. Rö.-Thorax zum Ausschluss einer Pneumonie. Ausführliche körperliche Untersuchung. Mikrobiologische Diagnostik (Blutkulturen, Rachenabstrich, Urin, etc.)
- Beginn einer empirischen antibiotischen Therapie mit breiter Abdeckung im grampositiven und gramnegativen Bereich, z.B. 3-fach-Antibiose i.v. (Gentamycin 240 mg 1-0-0, Piperacillin 4 g 1-1-1, Combactam 1 g 1-1-1).
- G-CSF-Applikation (Granocyte ® ) 1 x täglich
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
Nach einer febrilen Neutropenie, die trotz sekundär-prophylaktischer G-CSF-Gabe aufgetreten ist, muss die Dosis im nächsten Zyklus um einen Dosislevel gesenkt werden. In den weiteren Zyklen sollte dann wieder ein Therapieversuch mit der ursprünglichen Dosis unter sekundär-prophylaktischer G-CSF-Gabe vorgenommen werden! |
|
| |
|
|
|
|
|
|
|
|
|
Intervallverlängerung |
| |
|
|
|
|
|
|
|
|
|
Der nächste Zyklus kann wegen hämatologischer bzw. nicht-hämatologischer Toxizität um maximal 2 Wochen verschoben werden. Dies gilt auch für Gemzar ®, (d1 und d8):
Wenn Tag 8 um weniger als eine Woche verschoben wurde, soll der nächste Zyklus protokollgemäß gegeben werden. Liegt aber eine Zyklusverschiebung um eine Woche oder mehr vor, so sollte der nächste Zyklus soweit verschoben werden, dass der Abstand zum nächsten Zyklus 14 Tage beträgt.
Voraussetzungen für den neuen Zyklus sind:
- Neutrophile Granulozyten > 1.5 x 10 9/l oder Leukozyten > 2.0 x 10 9/l
- Thrombozyten > 100 x 10 9/l
Bei weiterer Intervallverlängerung muss mit der Studienleitung Rücksprache gehalten werden.
Unter Zoledronattherapie sollte das Serum-Kreatinin vor jeder Gabe überwacht werden. Bei Erhöhung des Kreatinins über den Ausgangswert bei Studieneintritt sollte ein Aussetzen aus der Therapie in Erwägung gezogen werden:
- War der Kreatinin-Grundwert bei < 1,4 mg/dl, verlangt eine Zunahme des Werts von mindestens 0,5 mg/dl ein Aussetzen aus der Therapie.
- Wenn der Kreatinin-Grundwert bei > 1,4 mg/dl lag, wird bei jeglicher Erhöhung des Kreatinins um 1,0 mg/dl oder mehr ein Aufschieben der Therapie erforderlich.
Die Therapie kann dann fortgesetzt werden, wenn der Kreatinin-Wert nicht mehr als 10% des Ausgangswertes beträgt.
Die Zoledronattherapie sollte dabei mit der gleichen Dosis wie vor der Behandlungsunterbrechung wieder aufgenommen werden. |
| |
|
|
|
|
|
|
|
|
|
Empfehlungen zur Dosisreduktion |
Randomisation A: |
|
|
|
|
|
| Randomisation B: |
|
|
|
|
|
|
Der Beginn der Zoledronattherapie ist 4 Wochen nach Ende der Chemotherapie vorgesehen.
Vor jeder Zoledronattherapie muss die Creatinin-Clearance bestimmt werden. Die Dosis von Zoledronat wird anhand der Creatinin-Clearance reduziert, wenn eine Crea-Clearance < 60 ml/min auftritt (s. Tabelle). Diese Dosierungen sollten dieselbe AUC erreichen, wie bei Patientinnen mit einer Crea-Clearance von 75 mL/min. Die Infusionsdauer sollte dabei nichtunter 15 min liegen. Zur Bestimmung der Crea-Clearance wird folgende Formel verwende |
| (Cockcroft-Gault-Formel): |
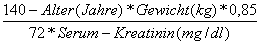 |
| |
|
|
|
|
|
|
|
|
|
| Creatinin-Clearance (mL/min) |
Zometa Dosierung* |
|
|
|
| ≥ 60 |
4.0 mg |
|
|
|
| 50 - 60 |
3.5 mg |
|
|
|
| 40 -49 |
3.3 mg |
|
|
|
| 30 - 39 |
3.0 mg |
|
|
|
| |
|
|
|
|
|
|
|
|
|
Hämatologische Toxizität
Die Chemotherapiedosis im folgenden Zyklus sollte reduziert werden, falls trotz sekundär-prophylaktischer G-CSF-Gabe mindestens eine der folgenden hämatologischen Toxizitäten auftraten:
- jede febrile Neutropenie (Temperatur > 38.0°C, Neutropenie < 0.5 x 10 9 /l, stationäre Aufnahme und intravenöse Antibiose)
- Neutropenie < 0,5 x 10 9/l über mehr als 5 Tage
- Thrombopenie NCI-Grad 4 (< 25,0 x 10 9/l)
- Intervallverlängerung wegen Leukopenie
|
| |
|
|
|
|
|
|
|
|
|
Nicht-hämatologische Toxizität
Toxizitäten werden anhand der NCI-Kriterien bewertet. Patientinnen mit einer nicht-hämatologischen Toxizität Grad 0-2 erhalten die vorgegebene Gesamtdosis. Falls für ein bestimmtes Symptom keine NCI-Graduierung beschrieben ist, sollte die Toxizität in der folgenden Form kategorisiert werden:
1 = schwach, 2 = mäßig, 3 = schwer und 4 = lebensbedrohlich |
| |
|
|
|
|
|
|
|
|
|
Gastrointestinal |
|
Mukositis NCI-Grad 3 |
Reduktion der Chemotherapie um 1 Stufe |
Mukositis oder Erbrechen NCI-Grad 4 |
Abbruch der Behandlung |
Hepatisch (unter Therapie mit Docetaxel) |
|
Erhöhung der Transaminasen (GOT oder GPT)
> 1,5fach oder der alkalischen Phosphatase > 2,5fach der oberen Normalwerte
|
Reduktion der Chemotherapie um 1 Stufe |
Erhöhung des Serumbilirubins > oberer Normalwert, oder der Transaminasenwerte > 3,5fach oder der alkalischen Phosphatase ³ 6fach der oberen Normalwerte |
Kein Fortführen der Behandlung mit Docetaxel, ggf. Umstellung auf FEC (500/100/500) für die noch ausstehenden Zyklen |
Neurologisch |
|
NCI-Grad 2 |
Reduktion der Chemotherapie um 1 Stufe |
NCI-Grad 3 (intolerable Parästhesien oder schlechter) und NCI-Grad 4 (Paralyse) |
Abbruch der Behandlung |
Pulmonal (v.a. in Hinsicht auf Gemcitabin) |
|
Pneumonitis ³ Grad 2, verursacht durch Gemcitabin |
Abbruch der Behandlung, Therapie mit Kortikoiden |
Kardial |
|
AV-Block Grad 1, asymptom. Bradykardie, isolierte asymptom. ventrikuläre Extrasystolen |
Weiterbehandlung unter kardialem Monitoring |
Behandlungsbedürftige Arrhythmie, AV-Block > Grad 1, LVEF-Abfall um >20% oder um >10% und LVEF unterhalb des Klinikgrenzwertes |
Abbruch der Behandlung
|
Andere gravierende Organtoxizität |
|
NCI-Grad ³ 3 (außer Alopezie, Übelkeit und Erbrechen) |
Abbruch der Therapie (bzw. Reduktion der Chemotherapie um 1 Stufe nach Ermessen des Prüfarztes)
|
Zeitpunkt
Untersuchung |
Vor Beginn der Therapie |
Vor jedem Zyklus |
28 Tage nach letzter Chemotherapie |
6 Wochen nach letzter Strahlentherapie |
Follow up
|
Demographische Daten |
X |
|
|
|
|
Ein- und Ausschlusskriterien |
X |
|
|
|
|
Einverständniserklärung d. Pat. |
X |
|
|
|
|
Registrierung/Randomisation |
X |
|
|
|
|
Anamnese |
X |
X |
X |
X |
X |
Klinische Untersuchung |
X |
X |
X |
X |
X |
Größe, Gewicht |
X |
X |
X |
X |
X |
Begleitmedikation |
X |
X |
X |
X |
X |
Begleiterkrankungen |
X |
X |
X |
X |
X |
Aktivitätsstatus (ECOG) |
X |
X |
X |
X |
X |
EORTC QLQ-C30 + BR23 Lebensqualitätsfragebogen |
X |
vor 4.Zyklus
|
X |
X |
X |
Blutentnahme für MRD-Surveillance |
X |
|
X |
|
2 und 5 Jahre nach Ende der Chemo-therapie |
Blutbild (Differential-BB erforderlich) |
X |
1-2x / Woche |
X |
|
b.B. |
Natrium, Kalium |
X |
X |
X |
|
b.B. |
Kreatinin |
X |
X |
X |
Zusätzlich vor jeder Zoledronat-therapie (s. a. Randomisation B) |
b.B. |
Bilirubin, GOT, GPT, γ GT, AP |
X |
X |
X |
|
b.B. |
Albumin, Eiweiß |
X |
|
X |
|
b.B. |
INR, PTT |
X |
|
X |
|
b.B. |
Schwangerschaftstest (prämenop.) |
X |
|
X |
|
|
Bildgebende Diagnostik (Lebersono, Knochenszinti, Röntgen-Thorax) bis 5 Wochen vor Randomisation
|
X |
|
|
|
b.B. |
Mammographie/ Mamma-Sonographie ipsilateral nach BET
|
|
|
|
|
In den ersten 3 Jahren alle 6 Monate, danach alle 12 Monate
|
EKG |
X |
|
X |
|
6 Monate nach CHT |
Toxizität (NCI) |
|
X |
X |
X |
X |
Überlebens-/Rezidivstatus |
|
|
X |
X |
X |


